마이크로 컬럼

박테리아는 유전변이 없이 다양한 항생제에 대해 일시적인(transient) 내성(tolerance)을 보일 수 있다 [1]. 현재 사용되고 있는 대부분의 항생제들은 박테리아의 성장 중 일어나는 DNA, RNA, 단백질 및 세포벽 합성과 같은 필수적인 생합성 과정을 저해함으로써 박테리아의 성장을 멈추게 하거나 사멸 시킨다. 하지만 박테리아가 비성장 휴면상태(non-growing dormant state)로 들어가게 되면 이러한 생합성 과정들이 일어나지 않거나 최소화되어 항생제들의 타겟이 비활성화 되고, 이로 인해 항생제는 항균작용을 할 수 없게 된다. 또한 aminoglycosides와 같이 세포 내로의 유입이 대사활성에 의존적인 항생제의 경우 타겟으로의 접근이 차단되게 되어 항균작용을 할 수 없게 된다 [2]. 이렇게 비성장 상태 및 대사활성의 최소화를 통해 나타나는 내성을 ‘tolerance’라고 정의하며, 이는 유전변이에 의한 항생제 내성인 ‘resistance’와 구분된다. 그리고 다양한 항생제에 대한 높은 tolerance를 나타내고 있는 비성장 휴면상태의 박테리아를 퍼시스터(persister)라고 한다 [3]. 박테리아 퍼시스터는 생물막 관련 감염(biofilm-associated infections) 및 만성 감염성 질환의 원인으로 알려져 있으며, 이러한 퍼스시터에 의해 유발된 감염의 경우 현재 항생제 화합요법으로 효과적인 치료가 어렵기 때문에 새로운 치료법 및 치료제 개발이 시급하다 [4].
2010년부터 퍼시스터에 효과적인 새로운 화학요법과 항균물질들에 대한 보고가 많이 되고 있다. 특히 그람양성균인 황색포도상구균(Staphylococcus aureus)은 액체배지(planktonic) 및 생물막(biofilm) 배양 시 많은 수의 퍼시스터를 형성하며 임상적으로 만성감염을 유발하는 대표적인 병원균이기 때문에, 이 균이 형성하는 퍼시스터를 제어하기 위한 연구들이 활발히 수행되어 왔다 [5]. 본 컬럼은 황색포도상구균 퍼시스터 사멸 전략 중 기존 항생제인 aminoglycosides의 항균활성을 증진시키는 방법에 대해 초점을 맞춰 소개해보도록 하겠다.
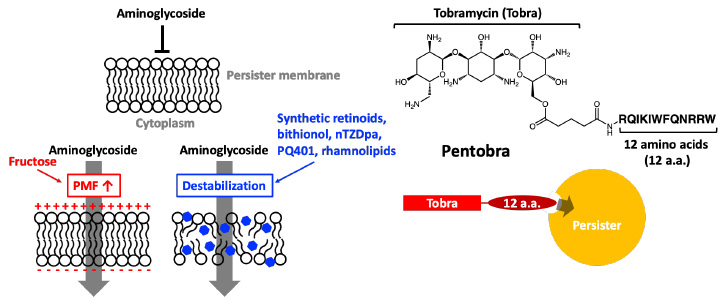
그림 1. 황색포도상구균 퍼시스터 세포 내로 aminoglycosides유입 전략
참고문헌
- Lewis, K. Persister Cells. Annu Rev Microbiol 2010, 64, 357–372, doi:10.1146/annurev.micro.112408.134306.
- Allison, K.R.; Brynildsen, M.P.; Collins, J.J. Metabolite-Enabled Eradication of Bacterial Persisters by Aminoglycosides. Nature 2011, 473, 216–220, doi:10.1038/nature10069.
- Balaban, N.Q.; Helaine, S.; Lewis, K.; Ackermann, M.; Aldridge, B.; Andersson, D.I.; Brynildsen, M.P.; Bumann, D.; Camilli, A.; Collins, J.J.; et al. Definitions and Guidelines for Research on Antibiotic Persistence. Nat. Rev. Microbiol. 2019, 17, 441–448, doi:10.1038/s41579-019-0196-3.
- Gollan, B.; Grabe, G.; Michaux, C.; Helaine, S. Bacterial Persisters and Infection: Past, Present, and Progressing. Annu Rev Microbiol 2019, 73, 359–385, doi:10.1146/annurev-micro-020518-115650.
- Kim, W.; Hendricks, G.L.; Tori, K.; Fuchs, B.B.; Mylonakis, E. Strategies against Methicillin-Resistant Staphylococcus aureus Persisters. Future Med Chem 2018, 10, e0127640-794, doi:10.4155/fmc-2017-0199.
- Taber, H.W.; Mueller, J.P.; Miller, P.F.; Arrow, A.S. Bacterial Uptake of Aminoglycoside Antibiotics. Microbiol Rev 1987, 51, 439–457.
- Kim, W.; Zhu, W.; Hendricks, G.L.; Tyne, D.V.; Steele, A.D.; Keohane, C.E.; Fricke, N.; Conery, A.L.; Shen, S.; Pan, W.; et al. A New Class of Synthetic Retinoid Antibiotics Effective against Bacterial Persisters. Nature 2018, 556, 103–107, doi:10.1038/nature26157.
- Kim, W.; Zou, G.; Hari, T.P.A.; Wilt, I.K.; Zhu, W.; Galle, N.; Faizi, H.A.; Hendricks, G.L.; Tori, K.; Pan, W.; et al. A Selective Membrane-Targeting Repurposed Antibiotic with Activity against Persistent Methicillin-Resistant Staphylococcus aureus. Proc Natl Acad Sci USA 2019, 116, 16529–16534, doi:10.1073/pnas.1904700116.
- Kim, W.; Steele, A.D.; Zhu, W.; Csatary, E.E.; Fricke, N.; Dekarske, M.M.; Jayamani, E.; Pan, W.; Kwon, B.; Sinitsa, I.F.; et al. Discovery and Optimization of NTZDpa as an Antibiotic Effective against Bacterial Persisters. ACS Infect Dis 2018, 4, 1540–1545, doi:10.1021/acsinfecdis.8b00161.
- Kim, W.; Zou, G.; Pan, W.; Fricke, N.; Faizi, H.A.; Kim, S.M.; Khader, R.; Li, S.; Lee, K.; Escorba, I.; et al. The Neutrally Charged Diarylurea Compound PQ401 Kills Antibiotic-Resistant and Antibiotic-Tolerant Staphylococcus aureus. mBio 2020, 11, 603, doi:10.1128/mbio.01140-20.
- Radlinski, L.C.; Rowe, S.E.; Brzozowski, R.; Wilkinson, A.D.; Huang, R.; Eswara, P.; Conlon, B.P. Chemical Induction of Aminoglycoside Uptake Overcomes Antibiotic Tolerance and Resistance in Staphylococcus aureus. Cell Chem Biol. 2019, 26, 1355-1364.e4, doi:10.1016/j.chembiol.2019.07.009.
- Schmidt, N.W.; Deshayes, S.; Hawker, S.; Blacker, A.; Kasko, A.M.; Wong, G.C.L. Engineering Persister-Specific Antibiotics with Synergistic Antimicrobial Functions. ACS Nano 2014, 8, 8786–8793, doi:10.1021/nn502201a.




